.
Egzamin maturalny z chemii na poziomie podstawowym rozpocznie się we wtorek o godz. 9. Uczniowie będą mieli 120 minut na rozwiązanie testu. Stawką jest 50 punktów do zdobycia.
We wtorek maturzyści stają również:
Chemia - rozszerzony [ARKUSZ, ODPOWIEDZI]
Równocześnie o tej samej godzinie startuje egzamin z chemii na poziomie rozszerzonym. Tutaj maturzyści mają pół godziny więcej na rozwiązanie, a maksymalna liczba punktów to 60. Arkusze i odpowiedzi będą dostępne na naszych stronach około godz. 14.
Drugi tydzień matur będzie upływał pod znakiem przedmiotów dodatkowych. Punkty za te przedmioty są ważne w kontekście rekrutacji na studia. Uczniowie mogą wybrać pomiędzy biologią, geografią, historią, wiedzą o społeczeństwie, filozofią, chemią czy fizyką z astronomią.
Matura 2013: Chemia - poziom podstawowy
ODPOWIEDZI
PRZYKŁADOWE ODPOWIEDZI - CHEMIA - POZIOM PODSTAWOWY
ZADANIE 1
1. Atom bromu ma 7 elektronów walencyjnych, które w stanie podstawowym znajdują się w czwartej powłoce. PRAWDA
2. Najwyższy stopień utlenienia, jaki przyjmuje brom w związkach chemicznych, wynosi VII. PRAWDA
3. Brom jest niemetalem aktywniejszym od chloru. FAŁSZ
ZADANIE 2
Liczba masowa
izotopu I - 40u
izotopu II - 45u
ZADANIE 3
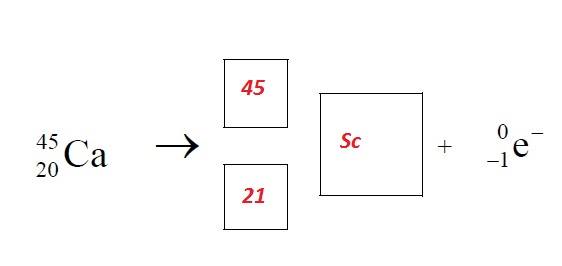
ZADANIE 4
ZADANIE 5
zestaw C
ZADANIE 6
ZADANIE 7
ZADANIE 8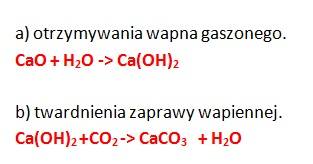
ZADANIE 9
Reakcja otrzymywania wapna gaszonego jest przemianą egzotermiczną, co oznacza, że podczas tej przemiany energia w postaci ciepła jest wydzielana.
ZADANIE 10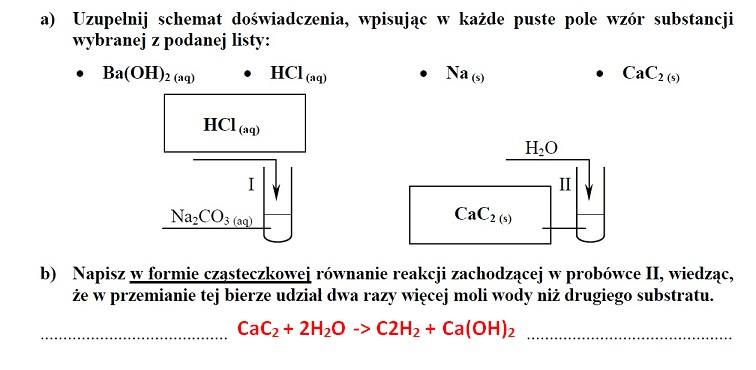
ZADANIE 11
Barwa wskaźnika: malinowa
Odczyn powstałego roztworu: zasadowy
ZADANIE 12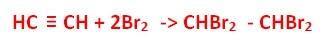
ZADANIE 13
ODPOWIEDŹ: Procentowa zawartość cynku w tombaku wynosi 80,4 %.
ZADANIE 14
1. Po dodaniu 90 gramów glukozy do 100 gramów wody o temperaturze 18°C i ogrzaniu całości do temperatury 25°C otrzymano roztwór nienasycony.
2. Stężenie procentowe (w procentach masowych) nasyconego wodnego roztworu glukozy jest równe 47,6% w temperaturze około 20°C.
ZADANIE 15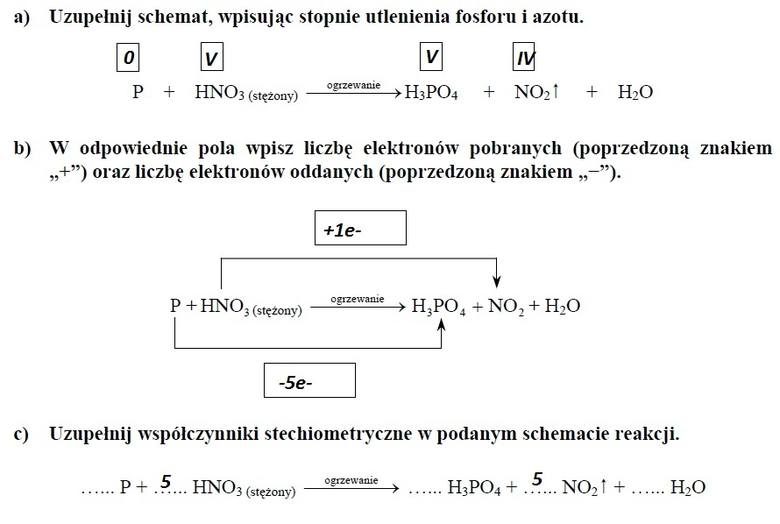
ZADANIE 16
1. W opisanej przemianie fosfor jest reduktorem, a kwas azotowy utleniaczem. PRAWDA
2. W opisanej przemianie stopień utlenienia fosforu obniża się. FAŁSZ
3. W opisanej przemianie fosfor ulega procesowi utleniania, oddając elektrony. PRAWDA
ZADANIE 17
Probówka I: bezbarwny
Probówka II: czerwony
ZADANIE 18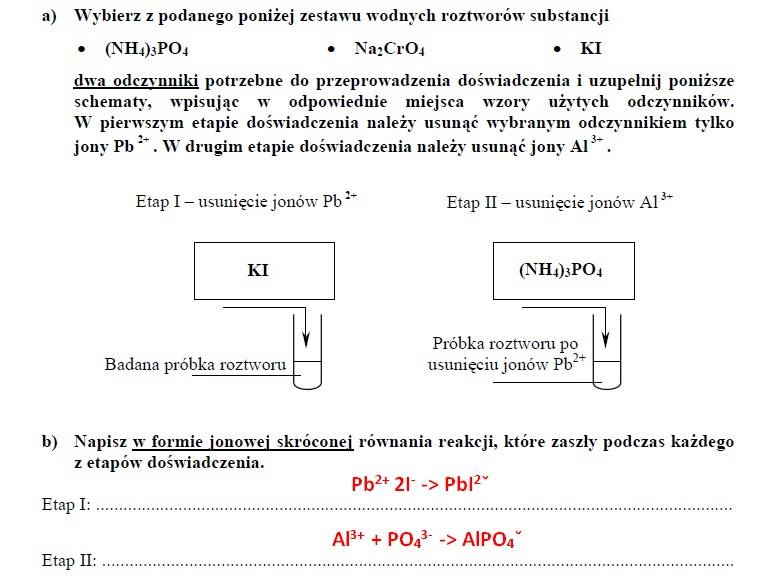
ZADANIE 19
2,2-dimetylopropan
ZADANIE 20
Związek oznaczony numerem I
B. tworzy dwie monochloropochodne.
ZADANIE 21
3,3 - dimetylobut - 1-en
ZADANIE 22
1. Homologami są związki oznaczone numerami III i V.
2. Izomerami są związki oznaczone numerami II i VI.
3. Butan powstaje w wyniku reakcji uwodornienia związku oznaczonego numerem III.
4. Utlenienie butan-2-olu prowadzi do otrzymania związku oznaczonego numerem VI.
5. Powstanie ceglastej substancji stałej można zaobserwować po ogrzaniu mieszaniny wodorotlenku miedzi(II) ze związkiem oznaczonym numerem II.
ZADANIE 23
Związek A należy do szeregu homologicznego alkiny
Związek B należy do szeregu homologicznego alkany
ZADANIE 24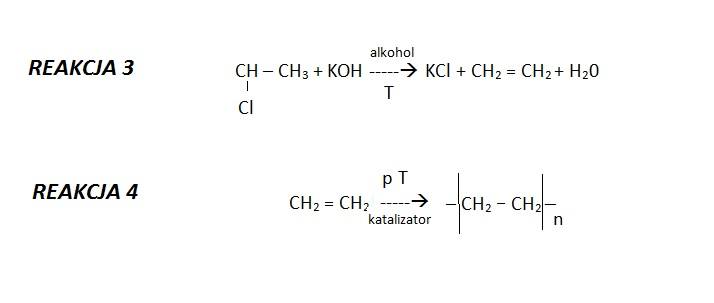
ZADANIE 25
Polietylen jest niereaktywnym związkiem organicznym używanym do produkcji artykułów codziennego użytku. Jest tworzywem palnym, które charakteryzuje się podatnością na barwienie i formowanie.
ZADANIE 26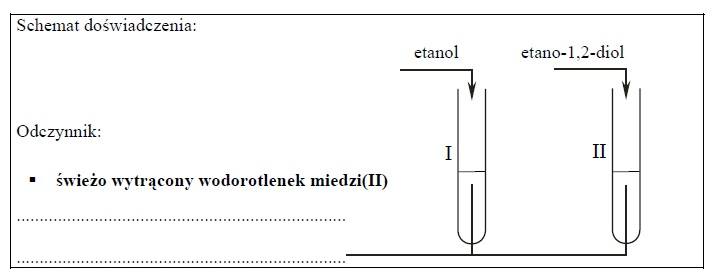
Probówka I: brak objawów reakcji
Probówka II: pojawia się szafirowe zabarwienie. Powstaje barwny roztwór
ZADANIE 27
ZADANIE 28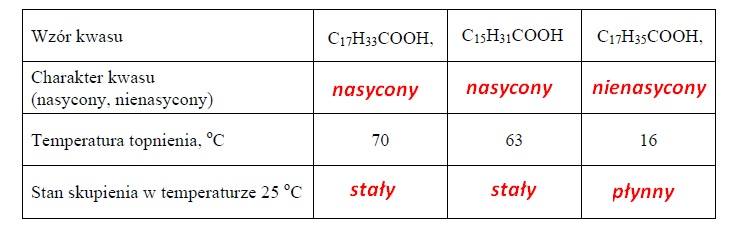
ZADANIE 29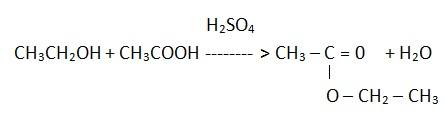
a) Ustal liczbę atomów węgla w cząsteczce opisanego estru.
4
ZADANIE 30
1. Związek X to substancja organiczna, która powstaje w wyniku reakcji nitrowania benzenu. PRAWDA
2. Związek organiczny otrzymany w wyniku redukcji związku X to amina aromatyczna o wzorze sumarycznym C6H7N. PRAWDA
3. Związek organiczny otrzymany w wyniku redukcji związku X nie reaguje z kwasem solnym, co potwierdza jego kwasowy charakter. FAŁSZ
ZADANIE 31
W celu przygotowania 0,5 dm3 wodnego roztworu glukozy o stężeniu 0,25 mol·dm-3 należy odważyć 22,5g glukozy. Odważoną próbkę glukozy należy przenieść do kolby miarowej o pojemności 500cm3 i dodać niewielką ilość wody w celu rozpuszczenia substancji. Następnie zawartość naczynia należy dopełnić 500cm3 do kreski znajdującej się na szyjce kolby miarowej.
echodnia.eu Świętokrzyskie tulipany
Dołącz do nas na Facebooku!
Publikujemy najciekawsze artykuły, wydarzenia i konkursy. Jesteśmy tam gdzie nasi czytelnicy!
Dołącz do nas na X!
Codziennie informujemy o ciekawostkach i aktualnych wydarzeniach.
Kontakt z redakcją
Byłeś świadkiem ważnego zdarzenia? Widziałeś coś interesującego? Zrobiłeś ciekawe zdjęcie lub wideo?










